新藥被批用於早期失智症
美國食品及藥物管理局在確定一項驗證性試驗中驗證了臨床益處後,將用於治療成年阿爾茲海默氏症的Leqembi轉為傳統批准。Leqembi是第一個從快速批准轉為傳統批准治療阿爾茲海默氏症β澱粉樣蛋白的抗體。
阿爾茲海默氏症(Alzheimer’s Disease)是一種不可逆轉的漸進性腦部疾病,常稱為失智症或老年癡呆,這種疾病會慢慢破壞患者的記憶和思維,最終影響行為和能力。阿爾茲海默氏症患者在65歲以前發病者,稱為早老性癡呆;65歲以後發病者稱老年性癡呆。阿爾茲海默氏症的治療難點在於其發病機制並未完全清晰,由於發病機制不明確,且目前還沒有治療該病症或逆轉大腦疾病的方法,現有藥物均只能緩解臨床症狀。全球各大製藥公司在過去二十多年,相繼投入數千億美元研發阿爾茲海默氏症的治療藥物。
減少大腦斑塊
雖然阿爾茲海默氏症的具體病因尚不完全清晰,但特點是大腦發生變化,包括β澱粉樣蛋白斑塊(Amyloid-β)和神經原纖維或tau蛋白纏結的形成,從而導致神經元連接的喪失,大腦清除失衡是神經元變性和認知障礙發生的因素,異常水平的β澱粉樣蛋白在大腦神經元之間形成的斑塊具有神經毒性,導致神經元變性。
由於β澱粉樣斑塊是阿爾茲海默氏症的一個明確病理生理學特徵,Leqembi(Lecanemab-irmb)的作用是減少大腦中形成斑塊。FDA於2023年1月時通過快速審批途徑批准使用,亦要求製藥公司進行臨床試驗,以驗證Leqembi的預期臨床益處。
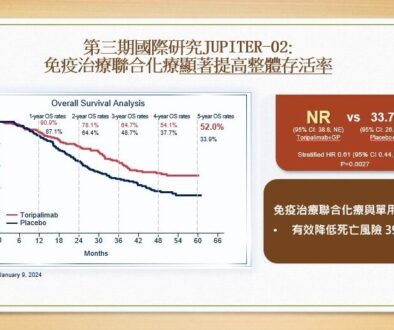
Leqembi的傳統批准是基於Clarity AD臨床試驗的III期數據。研究是一項多中心、隨機、雙盲、安慰劑對照、平行組研究,共1,795名阿爾茲海默氏症患者參與。對患有輕度認知障礙或輕度癡呆階段並證實存在β澱粉樣蛋白病理的患者開始治療。患者以 1:1 的比例隨機接受安慰劑或Leqembi,與安慰劑相比,Leqembi在主要終點(臨床癡呆評定量表總和評分)顯示出從基線到18個月的下降具有統計學意義和臨床意義的減少。
Leqembi是一種人源化免疫球蛋白單克隆抗體,針對聚集的可溶性(原纖維)和不可溶性形式的β澱粉樣蛋白,並可清除現有斑塊,以治療這種漸進的慢性疾病。Clarity AD臨床試驗數據證實了Leqembi對治療AD的臨床效益及確認了Leqembi的整體風險獲益。
副作用與風險
Leqembi最常見的副作用是頭痛、輸液相關反應和澱粉樣蛋白相關成像異常(ARIA),這是一種已知針對澱粉樣蛋白的抗體類會發生的副作用。ARIA最常表現為影像學研究中所見的大腦區域暫時性腫脹,通常會隨著時間消退,並可能伴有大腦內部或表面的小出血點。儘管ARIA通常沒有症狀,但亦可能會出現頭痛、意識模糊、頭暈、視力改變和惡心。ARIA也很少會出現嚴重且危及生命的腦水腫。
與安慰劑相比,使用Leqembi的患者使用抗凝藥物與腦出血數量增加相關。處方信息建議,在服用抗凝劑或存在其他腦出血危險因素的患者中使用 Leqembi時應謹慎。
Leqembi應該使用在患有輕度認知障礙或阿爾茲海默氏症輕度癡呆階段的患者中,這些患者是臨床試驗中研究治療的人群。3