H7N9禽流感病毒跨種傳染人類之因
H7N9禽流感病毒在2013年首先在中國內地爆發,自2016年入冬至今,病毒迅速擴散,全國感染宗數逾500宗。香港大學新發傳染性疾病國家重點實驗室及李嘉誠醫學院微生物學系的研究團隊發現H7N9禽流感病毒因基因突變,引致病毒容易感染人類,令禽流感疫情持續。
香港於1997年出現首宗人類感染H5N1禽流感個案。自1997年以來,多個國家已出現多種禽流感病毒感染人類的病例,H5N1禽流感病毒已經在全球感染超過800人,當中近一半人死亡。
H7N9
另一種H7N9禽流感病毒則在2013年首先在中國內地華東地區爆發,之後不斷有新增感染人類個案,至2017年初,全國已有17個省份的城市確認發生感染病例,總病例超過1200宗,其中400多例死亡。
儘管全國主要城市的活禽市場在2013年爆發後已經關閉,自2017年伊始至今短短三個月,H7N9禽流感累積感染個案迅速增加至超過380宗,其中121宗死亡。雖然其他禽流感病毒如H5N1及H9N2也有出現感染人類的情況,不過醫學界普遍認為H7N9病毒疫情並不尋常,亦未有研究揭示H7N9病毒廣泛感染人類的同時,卻又能在禽類有效傳播的原因。
禽流感病毒必須依賴宿主細胞進行繁殖才可異常地感染人類,這種特別的自然機制限制著不同物種間的病毒感染和傳播,所以一般的禽流感病毒是不容易感染和傳播至哺乳類動物和人類;同樣,季節性流感病毒也不會感染禽鳥。
香港大學新發傳染性疾病國家重點實驗室及李嘉誠醫學院微生物學系最新的研究揭示了H7N9禽流感病毒能在禽類有效傳播及可跨種感染人類的原因。研究團隊分析了2013年以來的H7N9病毒基因,發現所有H7N9病毒都在NS基因組,帶有一個名為「NS-G540A」的獨特突變。通過分子病毒學分析,研究團隊發現這個突變位於一個新發現的基因表達調控位點 ── 外顯子剪接增強子區(Exonic Splicing Enhancer,ESE)。所有流感病毒都有這個位點,屬於宿主細胞限制病毒繁殖和跨種感染的機制之一,而外顯子剪接增強子區及剪接調控蛋白SF2的相互作用,正是調節病毒在受感染的細胞中繁殖效率的關鍵,而這個突變可以增強H7N9病毒感染哺乳類細胞的能力。
研究團隊證明這突變增強H7N9病毒在哺乳類細胞的感染和繁殖能力,卻沒有減弱病毒在禽類細胞繁殖的效率(此突變在能感染人類的H10N8和H5N6禽流感病毒中也有出現)。病毒基因組分子溯源分析發現,突變從2000年已開始在H9N2病毒出現,此後在禽類逐年增加,到了2012年變成為禽類流行的主要病毒群體。2013年爆發的H7N9病毒是從H9N2病毒獲得內部基因,並與來自野鳥的血凝素(Haemagglutinin,HA)及神經氨酸苷酶(Neuraminidase,NA)重組,成為目前感染人類的H7N9病毒。

跨物種傳播
一般來說,能感染人類的病毒在禽類的繁殖和傳播會受到限制,但H7N9病毒帶有在哺乳類(包括人類)的細胞繁殖能力的獨特突變,卻同時在禽類中仍然有效傳播,這種適應性繁殖使H7N9病毒得到其他禽流感病毒沒有的跨種感染人類的能力,在接觸人類細胞時進行一定程度的繁殖,使H7N9病毒能夠比其他禽流感病毒更有效地跨種感染人類,引發疾病。
香港大學微生物學系教授陳鴻霖教授表示:「此新發現解釋了H7N9禽流感病毒在禽類流行同時又較容易感染人類的分子機制,為今後監測各種流行性禽流感病毒跨種感染人類的能力,以及防止未來禽流感病毒演變成有效在人與人之間傳播提供了重要的分子標記,這標記有助研發新型抗流感藥物,為控制病毒在哺乳類細胞有效繁殖提供新標靶。」
研究已於3月22日在國際期刊《自然通訊》(Nature Communications)中發表。3
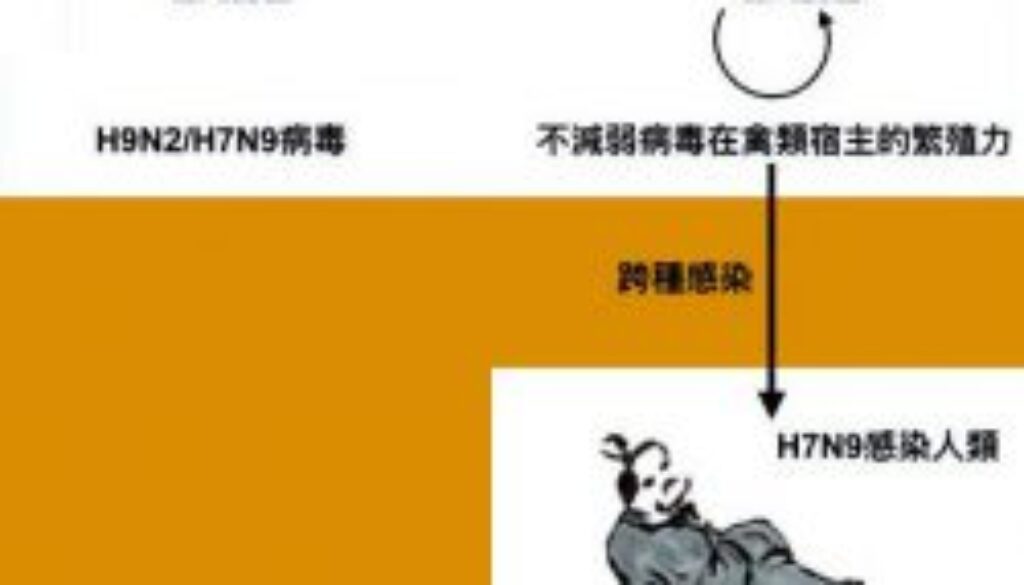
 H7N9禽流感病毒帶有NS-G540A基因突變,這突變能增強H7N9病毒在哺乳類細胞的感染和繁殖能力,但卻沒減弱病毒在禽類細胞繁殖的效率。
H7N9禽流感病毒帶有NS-G540A基因突變,這突變能增強H7N9病毒在哺乳類細胞的感染和繁殖能力,但卻沒減弱病毒在禽類細胞繁殖的效率。