刺激神經突再生可望治療腦創傷
香港中文大學生命科學學院副教授劉國輝領導的一個研究團隊最近發現了一種刺激神經突生長的新機制,為如何刺激神經突再生,以修復創傷性腦損傷(TBI)造成的神經損傷和治療神經退化性疾病提供了重要啟示。
創傷性腦損傷(Traumatic Brain Injury,TBI)是一種由外力引起的腦損傷,常見原因有跌倒、車禍、運動受傷或是被毆打而致,情況嚴重的話,可導致永久性殘缺。神經退化性疾病是一種大腦和脊髓細胞失去功能的症狀,包括阿茲海默症、柏金遜症、小腦萎縮症、肌肉萎縮性側索硬化症(漸凍人症)等。香港長者人口約有5-8%患有認知障礙症,當中大部分屬阿茲海默症,成為社會的沉重負擔。在這些疾病中,常有發現神經網絡受損 —— 神經元之間連接軸突出現退化和收縮的情況。
大腦是動物的指揮中心,由神經元組成。神經元透過從細胞體內長出的軸突(神經突)與其他神經元連接形成神經網絡,相互通信以調控不同的認知功能和身體活動。當神經突出現退化和收縮,無法維持神經網絡的正常聯繫時,患者的認知障礙和身體的運動功能將難以恢復,現時醫學界仍未有根治神經損傷的方法。

中大生命科學學院發現一種刺激神經突生長的機制,只要將兩種蛋白引入神經元之中,它們的相互作用可以將神經突的長度增加至少兩倍,此項發現為重新連接受損的神經網絡帶來新希望。
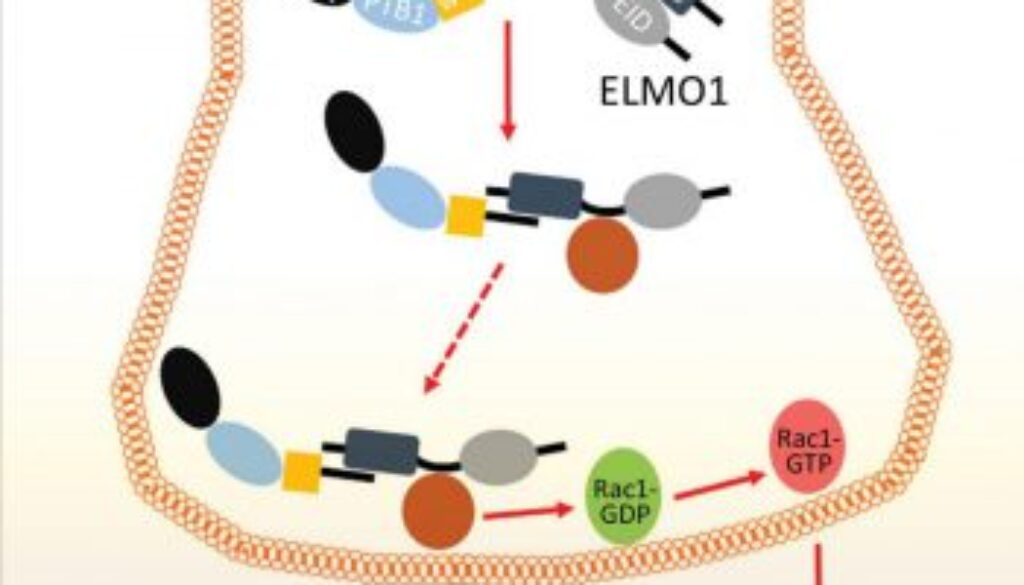
劉教授的研究小組發現的兩種蛋白為FE65和ELMO1,其相互作用可以刺激神經突生長。FE65是大腦中一種高表達轉接蛋白,與神經系統發育相關;而ELMO1則是一種廣泛表達的蛋白,各種細胞的遷移過程均有參與,但其在神經系統中的作用則從未報道。研究小組發現,通過將FE65和ELMO1引入哺乳動物的神經元,可促使神經突的長度增加兩倍或以上。相反,當兩種蛋白間的相互作用中斷,刺激作用完全消失。研究小組進一步發現這種相互作用驅使ELMO1移向細胞質膜,從而激活細胞膜上的Rac1 —— 神經突延伸必須經過細胞骨架重塑過程,Rac1則是這個過程的關鍵調節因子。

治療神經退化性疾病一個主要障礙是如何重新連接患者大腦中受損的神經元。劉教授認為,通過調控FE65-ELMO1相互作用,可以刺激這些細胞中的神經突再生,從而實現受損神經元的重新連接。研究為利用再生醫學方法治療腦損傷提供了新的方向。有關研究已於《Journal of Biological Chemistry》五月號刊登。3