乾眼症藥或可治子宮內膜異位
中大醫學院利用人工智能系統識辨出兩個子宮內膜異位症的新治療靶點,並發現治乾眼症的非類固醇抗炎藥物整合素抑制劑有助抑制異位內膜組織生長,具潛力成為子宮內膜異位症的新治療方案。研究結果已於《Advanced Science》發表。
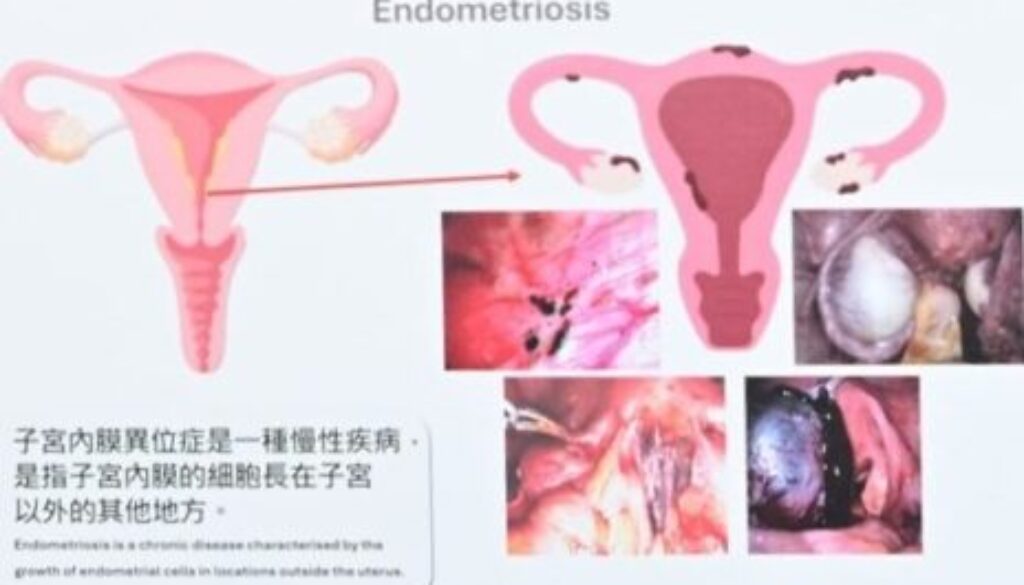
子宮內膜異位症(Endometriosis)是指子宮內膜組織生長在子宮的外部,可在盆腔、卵巢及其他位置形成異位內膜組織或囊腫。在卵巢出現的子宮內膜異位症,由於囊腫呈深棕色,因此又稱「朱古力瘤」。
影響育齡女性
子宮內膜異位症是常見的婦科疾病,影響全球百分之五至十五正值生育年齡的女性,主要病徵是腹部不適,部分患者更會出現下腹及盆腔疼痛。子宮內膜異位症會影響患者的月經周期和生育能力,甚至演變成卵巢癌(Ovarian Cancer)。由於子宮內膜異位症成因不明,現時尚未有根治療法,主要治療是透過止痛方式和進行荷爾蒙治療以減輕症狀,情況嚴重的患者可透過手術切除異位組織和囊腫。
中大醫學院婦產科學系臨床副教授鍾佩樺醫生表示:「子宮內膜異位症有高復發風險,目前的止痛方式及荷爾蒙治療只能暫時緩解症狀,長期服用荷爾蒙藥物亦可能產生副作用,因此需要探索新治療方案。」
中大醫學院婦產科學系系主任及臨床教授潘昭頤表示:「中大醫學院婦產科致力推動婦科疾病的創新研究,是次研究與本地一所人工智能生物醫學科技公司合作,利用先進的人工智能輔助系統,分析大型表達基因數據,成功找出子宮內膜異位症的非荷爾蒙類新治療靶點。我們期望研究成果有助治療子宮內膜異位症,改善患者的生活質素。」
縮小異位內膜組織
研究團隊利用人工智能系統,針對異位內膜組織的表達基因大數據進行分析,尋找可以透過藥物抑制的新治療靶點,發現一種調節免疫及抑制炎症過程的「環腺苷酸結合蛋白2」(Guanylate-binding Protein 2,GBP2)以及負責細胞增殖及生物訊號傳導的「造血細胞激酶」(Hematopoietic Cell Kinase,HCK)均具有治療子宮內膜異位症的潛力。研究團隊利用子宮內膜異位症的小鼠模型進行驗證,發現消除小鼠體內的GBP2和HCK蛋白後,異位內膜組織的體積和重量明顯減少,亦抑制病變組織細胞的增長,更令部分病變組織細胞死亡。

領導研究的中大醫學院婦產科學系教研室主任黃志超教授表示:「確定GBP2和HCK作為新治療靶點,有助我們理解子宮內膜異位症的疾病發展機制,從而計劃更精準及有效的治療策略。GBP2和HCK在人體子宮內膜異位樣本中的基因表達更強,顯示它們與子宮內膜異位症有強烈的關連性。」
整合素β2
研究團隊利用人工智能系統同時發現用於治療乾眼症的抑制劑有潛力成為治療子宮內膜異位症的藥物。基於負責調控白血球黏附和遷移的整合素β2(ITGB2)蛋白在人體子宮內膜異位樣本中的基因表達水平上升,團隊透過小鼠模型實驗,證實這種用於治療乾眼症的整合素抑制劑可有效抑制異位內膜組織生長,未來或可成為臨床治療子宮內膜異位症的新藥物。透過人工智能發現新藥,更可以大大縮短藥物研發的過程和時間,使新藥更快應用於病人身上。3