新研究揭示胃癌發展變化
港大醫學院臨床醫學學院病理學系的研究團隊近期兩項創新研究在理解胃癌最早期發展變化取得突破,有望改變現行的胃癌預防策略。
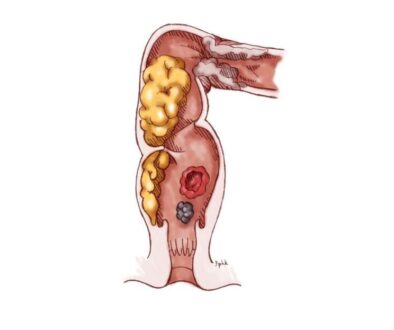
胃癌是全球最致命的癌症,在東亞地區 —— 尤其中國的發病率極高。在香港,約有15%人口感染幽門螺旋桿菌而引起慢性胃部炎症,而持續的炎症可導致癌前病變,即「腸化生」(Intestinal Metaplasia)。
胃部酸性環境有助消化食物,但隨年齡增長,這種強酸環境可能誘發正常胃組織的致癌突變。然而,對於這些早期變化的發生時序、機制及其如何促進癌症進展,醫學界仍缺乏深入了解。
香港大學李嘉誠醫學院、英國維康桑格研究所及美國麻省理工學院—哈佛大學博德研究所科研人員合作的一項研究,利用先進基因組測序技術分析正常胃黏膜組織的基因突變。團隊首次對238個樣本進行全基因組測序,並對另外829個樣本進行靶向測序;這些樣本來自香港、美國和英國胃癌患者及非癌症患者。研究揭示儘管胃部處於強酸環境,胃黏膜仍具有保護機制防止顯著基因突變。
研究顯示,基因突變數量會隨年齡增長而增加。正常胃腺體每年累積約28個突變,但胃癌患者的突變率是正常的兩倍多,尤其在腸化生腺體中更為顯著。此研究的共同主要作者、港大醫學院臨床醫學學院病理學系系主任梁雪兒教授表示:「人們到60歲時,有近一成胃黏膜會出現已知癌症基因突變,可見這些潛在致癌變化需歷經數十年累積。」
研究最驚人的發現,是部分胃部區域存在染色體異常且與慢性炎症相關。正常細胞通常每種染色體有兩份副本,但研究人員發現某些患者的胃細胞擁有三套染色體。令人震驚的是,這額外的染色體通常於患者12-25歲青少年時期出現,這意味可能是由於早年接觸過致癌的突變原,如感染性病原體。
胃癌的風險因素包括吸煙、酗酒、高鹽飲食及幽門螺旋桿菌感染。梁雪兒教授指出:「我們的跨國團隊發現,長期胃部炎症患者的基因突變或額外染色體明顯多於常人,顯示炎症可能自早年就開始塑造癌前環境。」
整體而言,這項研究為胃腸道的突變圖譜提供有力證據,揭示癌症形成前已出現的早期突變,這對早期檢測與預防策略具重要意義。
建3D模型類器官生物庫
在另一項相關研究中,港大醫學院與InnoHK腫瘤及免疫學研究中心的研究人員聚焦於胃癌的癌前病變現象「腸化生」。腸化生是胃部細胞轉變為類似腸道細胞的過程,此變化會大幅增加胃癌風險,但其癌化過程仍不清楚。共同領導這項研究的港大醫學院臨床醫學學院病理學系助理教授甄凱寧及梁雪兒教授,利用「類器官培養」技術建立全球首個腸化生的3D模型類器官生物庫。類器官是取自患者組織於實驗室培養的微型器官模型,因其源自患者自身組織,能真實模擬腸化生轉變為胃癌的過程。港大病理學系助理教授甄凱寧表示,團隊從瑪麗醫院47名胃癌患者的組織(涵蓋正常至晚期腸化生階段)培養出70個類器官。
以上研究發表於《腸道》期刊,結果顯示腸化生類器官含有兼具胃與腸道特徵的「混合型細胞」。正常細胞有固定身分(胃細胞保持胃形態),但這些混合型細胞呈現混亂狀態,既像胃細胞又像腸細胞。此外,混合型細胞表達通常僅在胎兒發育期活躍的基因,使其能轉化為不同類型細胞。這種改變能力與癌細胞適應能力相似,會不受控制地生長,因此了解此靈活特性對研究癌症發展與抗藥性問題至關重要。
另一重要發現是腸化生細胞常帶有三套第20號染色體,且這些細胞能在無附著狀態下生長,這些特徵通常與癌細胞擴散至其他組織有關,因此識別與腸化生相關的特定基因變化,有助發現胃癌的早期預警,以及早找出可能的癌變靶點作出干預。
全球腸化生盛行率達25%,亟需識別高風險族群以進行針對性干預。病理學系助理教授甄凱寧解釋:「透過類器官技術,我們能識別胃細胞發展為癌細胞的早期變化。這些早期徵兆可助醫生評估識別出屬胃癌高風險族群的人士,同時讓低風險的腸化生患者安心。我們的目標是加速偵測這些早期徵兆,並將此技術應用於臨床以改善風險評估。」
梁雪兒教授表示:「成功建立活細胞模型後,下一步可望開發逆轉腸化生的藥物。這些突破為對抗胃癌帶來新希望,可能徹底改變患者的預後與臨床實踐。」3