歐盟批第一個IDH1抑制劑
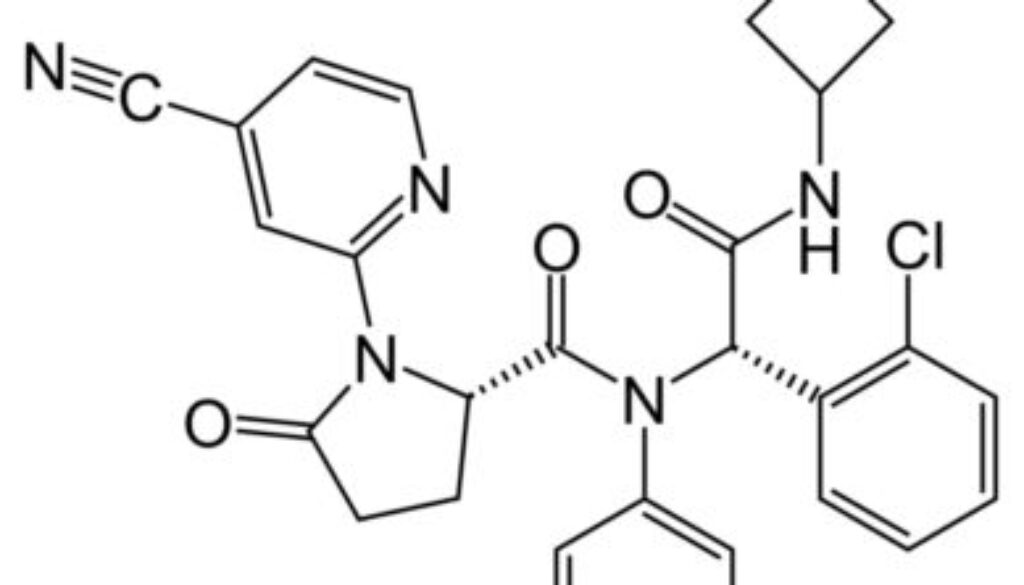
歐盟委員會批准Ivosidenib作為兩種難治性腫瘤的標靶治療藥物,即急性髓性白血病和晚期膽管癌,是第一個在歐洲獲得批准使用的IDH1抑制劑。
口服Ivosidenib是一種異檸檬酸脫氫酶-1(Isocitrate Dehydrogenase-1,IDH1)抑制劑,適用於治療被檢測攜帶易感IDH1突變、患有復發或難治性急性髓性白血病(AML)的成人患者,於2018年在美國首次獲得批准,用於治療一線和復發/難治性(Relapsed/Refractory,R/R)的AML患者,以及膽管癌患者。2022年,亦得到中國國家藥監局批准進入中國市場。
Ivosidenib被批准與Azacitidine聯合用於治療不適合接受標準化療的被診斷出現異檸檬酸脫氫酶-1(IDH1)R132突變的急性髓性白血病(Acute Myeloid Leukemia,AML)成年患者;以及單一用於治療具有IDH1 R132突變的晚期或轉移性膽管癌(Cholangiocarcinoma)成年患者。
AML存活率低
急性髓性白血病(Acute Myeloid Leukemia,AML)是一種進展迅速的血液和骨髓癌症,是成人中最常見的急性白血病,75歲以上AML患者的兩年生存率低於10%。一直以來,被診斷出患有急性髓性白血病或膽管癌患者的預後一直很差,治療選擇亦非常有限。
歐盟委員會(The European Commission)對Ivosidenib的批准是根據一項發表在「新英格蘭醫學雜誌」(New England Journal of Medicine)上的試驗研究。研究是一項全球性、第三期、多中心、雙盲、隨機、安慰劑對照的臨床試驗,結果證明Ivosidenib+Azacitidine是新診斷IDH1突變AML患者的有效聯合治療選擇。最常見的不良反應是嘔吐、中性粒細胞減少、血小板減少、心電圖QT間期延長和失眠。
膽管癌只手術可治
膽管癌(Cholangiocarcinoma)是一種較罕見的侵襲性腫瘤,通常與肝硬化或肝感染等病史有關。在歐洲,五年存活率為9%,如果出現轉移,生存率幾近零,只有手術被證明可以治愈患者,但手術治療僅適用於條件適合的有限數量患者,且復發風險高,若不適合手術或術後病情復發的膽管癌患便需要使用化療和免疫治療。
歐盟委員會對Ivosidenib用於膽管癌的批准是根據一項名為ClarIDHy的試驗,這是一個針對曾經接受治療的膽管癌IDH1突變隨機第三期試驗。研究的結果表明,隨機分配至Ivosidenib的IDH1突變晚期膽管癌患者,Ivosidenib治療與安慰劑相比在數值上提高了整體生存益處。
Ivosidenib保留了一定的生活質量並且耐受性良好。最常見的不良反應是疲倦、惡心、腹痛、腹瀉、食欲下降、腹水、嘔吐、貧血和皮疹。3