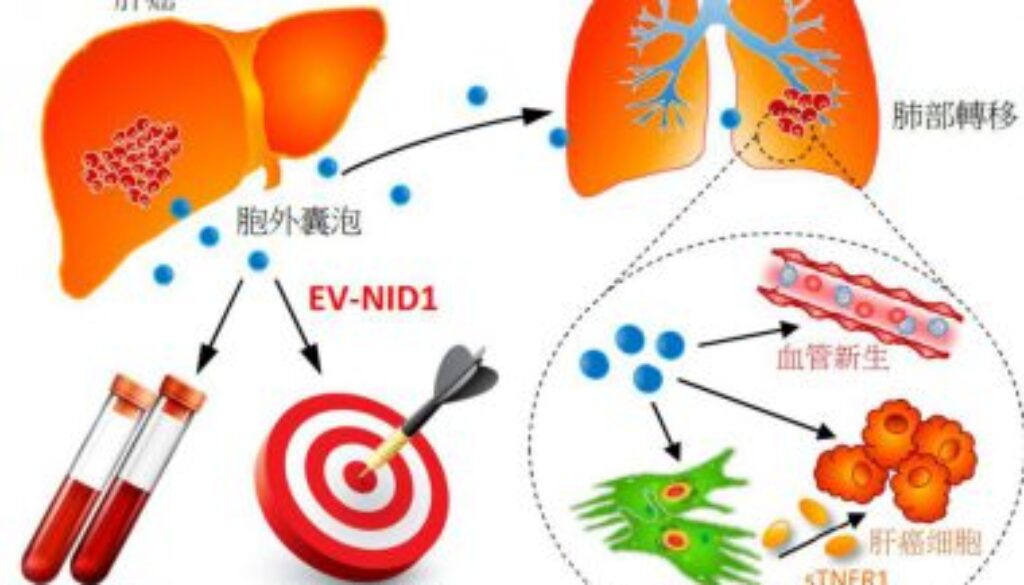
胞外囊泡成肝癌轉移新靶點
香港大學醫學院研究團隊發現,腫瘤來源的胞外囊泡會促進肝癌轉移。這項發現為肝癌治療提供了新的生物指標及治療方向。相關研究已於國際期刊《尖端科學》發表。
肝癌是全球最常見的腫瘤疾病之一,每年有超過84萬個新症,在中國大陸和香港尤其普遍。香港每年新增約1,800肝癌病例,而每年因肝癌死亡的數目高達1,500人。全港約8%人口是乙型肝炎病毒(Hepatitis B Virus,HBV)攜帶者,而80%肝癌病人都與乙肝病毒感染有關。肝癌的高死亡率基於缺乏早期診斷手段,以及癌細胞極易轉移和復發。多數晚期確診患者都已錯過手術治療的黃金機會,餘下治療方法亦十分有限。有見及此,研究重點著重於尋找早期診斷的生物指標以及探索新的治療方法。
胞外囊泡促進轉移
研究團隊通過小鼠模型,發現肝癌細胞來源的胞外囊泡(Extracellular Vesicles,EVs)會促進腫瘤的生長以及向肺部轉移。研究團隊更發現EVs中的蛋白Nidogen 1(NID1)對於EVs促使腫瘤生長及轉移的作用至關重要。從功能上來說,EV-NID1能增生血管,並激活成纖維細胞,分泌出腫瘤壞死因子受體1(Tumor Necrosis Factor Receptor 1,TNFR1),令腫瘤細胞在肺部定植。此外,EV-NID1更會加劇腫瘤細胞的增殖、轉移和侵襲性。
抑制EV-NID1可大幅度減低EVs促進腫瘤生長及轉移的作用。在小鼠實驗中,利用抗TNFR1抗體可以有效地減輕肝癌EVs誘導的腫瘤肺部轉移。而在臨床觀察中,肝癌病人血清EV-NID1和TNFR1的含量都較正常對照組為高。
堵截胞外囊泡

領導這項研究的病理學系副教授任蕙蘋博士表示:「是次研究結果是首度在肝癌病人的胞外囊泡中找到NID1,並證實EV-NID1在促進肝癌發展和轉移至肺部的一個未知功能。我們希望靠堵截腫瘤細胞來源胞外囊泡的傳送及其信號通道,為未來肝癌治療提供一種新選擇和方法。」
該研究的發現,對於肝癌的臨床治療具重要意義。首先,團隊鑑定了肝癌的始動分子,為設計新療法立下根基。其次,在肝癌病人的樣本中,發現其血清EV-NID1和TNFR1的表達水平與其腫瘤分期正向相關,說明了這兩個分子有望作為肝癌早期診斷的非侵入型生物指標。最後,該研究提供了治療肝癌的新方向,通過標靶腫瘤性的EVs及其介導的通路,為肝癌病人提供新的治療選擇。3