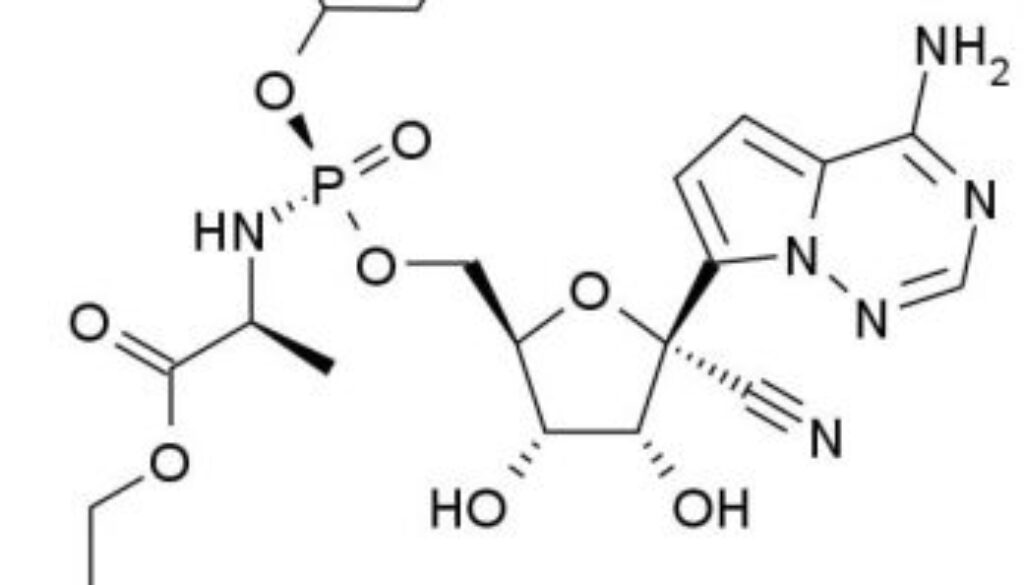
治療新冠肺炎新藥進入第三期臨床
雖然美國總統認為把2019冠狀病毒病(新冠肺炎)當成流感就可以,但現時的流感尚有疫苗,也有藥物應用,2019冠狀病毒病則尚未有確切治療方案,令原本研發為對抗伊波拉病毒的Remdesivir備受矚目,藥物亦進入第三期臨床研究!
研發Remdesivir的製藥公司Gilead Sciences宣布啟動兩項第三期臨床研究,針對確診患有2019冠狀病毒病(Corona Virus Disease 19,COVID-19)的成人,評估Remdesivir的安全性和療效。這些隨機分配、開放標籤、多中心的研究即將在3月開始,主要在亞洲國家及其他確診案例較多的國家招募約1000名患者,並於各大醫學中心進行研究。
研究將評估靜脈注射Remdesivir的兩個用藥療程。這兩項研究的試驗性新藥 (Investigational New Drug,IND)申請已得到美國食品及藥物管理局(Food and Drug Administration,FDA)的快速審核及許可。兩項全新臨床研究包括中國中日友好醫院在中國湖北省主導的兩項臨床研究,以及由美國國立過敏與傳染病研究院(U.S. National Institute of Allergies and Infections Disease,NIAID)在美國啟動的另一項臨床研究。
Gilead Sciences首席醫療官Merdad Parsey醫學博士表示:「目前主要專注於快速確認Remdesivir於治療COVID-19的安全性和療效,而這一系列的輔助研究可協助我們取得更廣泛的全球數據,在短時間內更了解藥物特性。Remdesivir在冠狀病毒臨床發展的速度反映治療選擇的急迫需求,以及業界、政府、全球衛生組織和醫護人員共同承諾以最緊急程度應對這次公衛威脅。」
研究方法
Gilead Sciences會評估Remdesivir的兩段用藥療程。一項研究會隨機分配約400名臨床症狀嚴重的COVID-19患者,接受5天或10天Remdesivir;第二項研究則是隨機分配約600名臨床症狀中度的COVID-19患者,接受5天或10天的Remdesivir,或僅接受標準治療方案。兩項研究皆以臨床改善作為主要評估指標。
第一項研究將會針對嚴重症狀的COVID-19患者,評估其透過靜脈施用Remdesivir後,於5天和10天用藥療程的安全性和療效。約有400名參加者以1:1的比例隨機分配,除了標準護理外,患者需在第1天接受Remdesivir 200 mg,之後在第5天或第10天前,每天100 mg。此項研究藉由測量發燒和血氧飽和度的正常化,以達到評估藥物影響的主要目標 —— 經過第14天,持續至少24小時:腋溫<36.6℃、口溫<37.2℃、肛溫<37.8℃、血氧飽和度> 94%。
第二項研究則是針對中度症狀的COVID-19患者,評估其透過靜脈使用Remdesivir於5天和10天用藥療程的安全性和療效,並與接受標準護理的患者比較。約有600名參加者以1:1:1 的比例隨機分配,除了標準護理方案外,需在第1天接受Remdesivir 200mg,之後在第5天或第10天前,每天需接受100mg,並與僅接受標準護理方案的患者比較。此項研究藉由測量每一組參加者於第14天出院的比例,以達到此研究評估Remdesivir影響的主要目標。
甚麼是Remdesivir?
Remdesivir是研究性核苷酸類似物,在動物模式研究中,能對出現的多種病毒病原體 —— 包含伊波拉病毒(Ebola Virus)、馬堡病毒(Marburg Virus)、中東呼吸綜合症病毒冠狀病毒(MERS-CoV)、嚴重急性呼吸系統綜合症冠狀病毒(SARSr-CoV)在體內和體外廣泛產生抗病毒活性。此藥亦在健康的自願者及伊波拉病毒感染患者身上使用,不過個別恩恤用藥案例不足以決定藥物用於COVID-19病患者的安全性和療效,唯有透過前瞻性的臨床研究,才能進一步確認。
由於Remdesivir目前尚未在全球任何地區獲得許可或批准,並且尚未證實對任何使用都是安全有效,故此相關的製藥公司一再強調,與政府機關、非政府組織和當地主管機關攜手合作,以「恩恤用藥」方式提供Remdesivir給符合資格的COVID-19病患者,作為緊急用藥。
Gilead Sciences在兩項臨床研究提供試驗藥物,並為這些研究提供科學建議,其中中國的臨床研究結果預計將於4月公布。3